前沿 | 复旦大学发现肝内胆管癌靶向治疗新策略-pg电子官方
近日,复旦大学研究团队在期刊《cell reports》上发表了题为“loss of α-1,2-mannosidase man1c1 promotes tumorigenesis of intrahepatic cholangiocarcinoma through enhancing cd133-fip200 interaction”的研究论文,本研究中,研究人员发现肝内胆管癌(icca)组织中α 1,2-甘露糖基化cd133的水平与干性基因的水平相关。α 1,2-甘露糖修饰的cd133 细胞具有肿瘤起始细胞的特征。α 1,2-甘露糖基化的cd133是icca起始细胞的功能标志物。

研究背景
肿瘤起始细胞(tics)与肿瘤的发生、复发和转移密切相关。因此,tics被认为是最有希望的肿瘤治疗靶点。迄今为止,tics的鉴定主要基于表面标记。cd133是一种五跨膜糖蛋白,已被广泛用作分离tics的标志物,包括肝癌、胶质瘤和结肠癌。而cd133在干细胞和分化细胞上均有表达。越来越多的证据表明,cd133表面n -糖链结构与干细胞特性相关。在肿瘤干细胞分化过程中,cd133表面n -糖链结构发生变化。缺氧可增强胶质瘤干细胞中cd133的糖基化。此外,改变cd133的糖基化会影响其稳定性或功能。n -糖基化复合物通过增强cd133与tsg101的相互作用促进cd133的分泌。缺氧诱导糖基转移酶8结构域1 (glt8d1)通过抑制cd133降解促进胶质瘤干细胞维持。然而,cd133的n -糖链结构与干细胞特性之间的关系尚不清楚。
肝内胆管癌(icca)是第二常见的肝癌。icca的5年生存率为9%。由于复发率高,icca仍然是一种棘手的疾病。icca与超重/肥胖和慢性肝病(包括肝硬化和/或病毒性肝炎)有关。必须探索icca的分子机制,以开发新的治疗策略。鉴定icca起始细胞的标记物可能有助于icca靶向治疗的发展。虽然cd133的表达与icca的转移和低存活率有关,但cd133在鉴别icca启动细胞中的作用尚不清楚。
研究进展
研究人员评估了man1c1在icca中的表达特征。免疫组化分析显示,man1c1在各种正常组织中均有表达。在tcga数据集中,man1c1的表达在包括胆管癌在内的肿瘤样本子集中显著降低。man1c1的低表达与各种癌症的不良预后相关。因此,低man1c1表达与癌症进展有关。
接下来,研究人员评估α-1,2- man是否有助于icca启动细胞的特性。肿瘤干细胞(cancer stem cells, cscs)主要存在于低糖或营养储存的微环境中。在1-2代低糖条件下,异位表达flag标记的man1c1显著减少α-1,2- man cd133 细胞的球形成。极限稀释分析被广泛应用于干细胞频率的测定。
通过体外有限稀释实验,研究人员发现man1c1过表达抑制了cd133 α-1,2- man 细胞的干细胞活性。man1c1的异位表达抑制了cd133 α-1,2- man 细胞的肿瘤启动能力,提高了肿瘤小鼠的存活率。总之,通过man1c1过表达抑制α-1,2- man修饰抑制了icca启动细胞的自我更新和肿瘤发生。
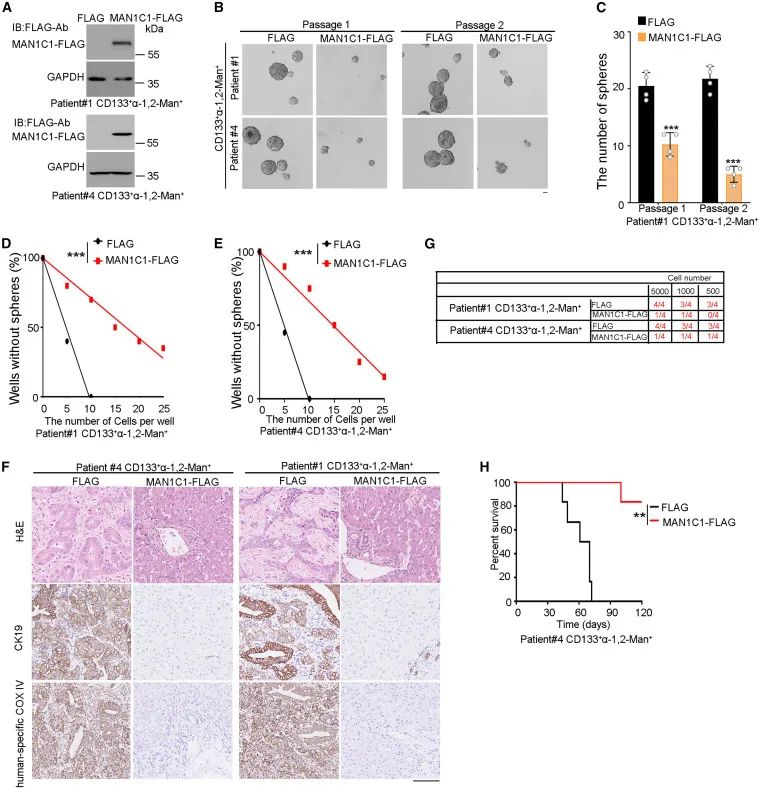
通过man1c1过表达抑制α-1,2- man可抑制icca启动细胞的肿瘤发生
fip200是哺乳动物细胞自噬体形成所必需的。在营养剥夺或缺氧的情况下,自噬维持tic的自我更新。α-1,2-man对icca启动细胞自噬的作用。lc3-i向lc3-ii的转化被用作自噬激活的指标。man1c1过表达显著降低cd133 α-1,2- man 细胞中lc3-ii与lc3-i的比值。当自噬被激活时,绿色荧光蛋白连接lc3 (gfp-lc3)集中在自噬液泡中形成点状绿色荧光。man1c1的异位表达减少了gfp-lc3小点的形成。总的来说,man1c1减少了icca启动细胞的自噬。
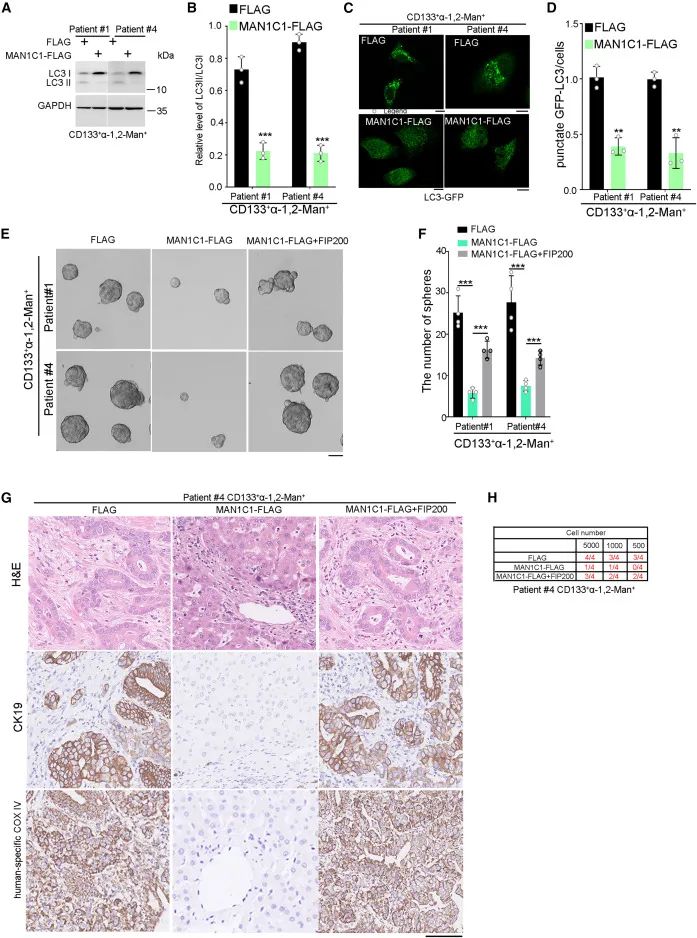
α-1,2- man通过上调自噬基因fip200增强icca启动细胞的自我更新和肿瘤发生能力
接下来,研究人员评估了fip200在man1c1降低的自噬中的作用。fip200的异位表达阻断了man1c1对cd133 α-1,2- man 细胞自噬的负性作用,man1c1过表达对cd133 α-1,2- man 细胞自我更新的抑制作用被fip200过表达部分挽救。过表达fip200可逆转man1c1对cd133 α 1,2- man 细胞的抑制作用。综上所述,α 1,2- man通过上调fip200的表达来增强肝内胆管癌起始细胞的自我更新和成瘤能力。
研究结论
综上所述,cd133 α-1,2-甘糖基化是icca启动细胞的功能标志物,为tic提供了更特异性的标志物。本发现提供了cd133的n -聚糖结构与干细胞特性之间的关系,并提供了消除icca启动细胞的新策略。(来源:)
参考资料:
https://www.cell.com/cell-reports/fulltext/s2211-1247(23)01600-5#