前沿 | 相分离对线粒体和细胞核中基因组的调控作用-pg电子官方
biophysics reports 2023年第3期以封面文章的形式,发表了中国科学院广州生物医药与健康研究院刘兴国研究员为通讯作者、广州医科大学生命科学学院龙琪副教授及周艳双副教授为共同第一作者的综述文章“multi-phase separation in mitochondrial nucleoids and eukaryotic nuclei”,详细论述了多相相分离调控线粒体类核及细胞核结构的形成,以及转录功能的机制。
相分离是生物大分子在特定状态下的一种特殊的自发凝聚现象。相分离在无膜细胞器及细胞和染色质结构的形成,以及生化反应调节等功能中起着关键作用。最新研究发现,药物与生物大分子的相分离可能是决定药物靶向性和功能发挥的关键。
线粒体是哺乳动物细胞内唯一含有自身遗传物质的细胞器。与细胞核染色质类似,线粒体基因组通过折叠,包装形成球形的特殊亚细胞器结构,这一亚细胞器结构被称为线粒体类核。线粒体类核是线粒体基因组储存、复制及转录的重要场所。
刘兴国实验室发表在nat sruc mol biol的研究(pmid: 34711968)发现,线粒体转录因子 a (tfam) 可以通过内在无序区域结构发生相分离聚集,而tfam结合线粒体基因组后,可以进一步自发相分离,驱动线粒体类核的自组装,聚集为尺寸均一的液滴。线粒体类核的相分离过程与细胞核内染色质的相分离凝聚类似,并具有相近的特性。
作者提供的封面巧妙地描绘了线粒体的自组装过程。将tfam具象为诞生于仙石中的美猴王,周围环绕的崇山峻岭如线粒体内嵴,七彩仙石的多层结构则代表线粒体类核。这个封面将科学与神话相结合,充满了想象力,也诠释了研究的科学内涵。

图1 biophysics reports 2023年第3期封面
该综述着重论述了相分离调控线粒体类核与细胞核转录的机制。线粒体起源于古细菌,经过长期的进化,其基因组演化出了既不同于古细菌的单转录酶转录的简单方式,也不同于细胞核的复杂调控方式。
线粒体转录是一个多步骤、多复合物参与的精确调控过程,参与的复合物包括转录起始复合物、转录延伸复合物及终止复合物。已有的研究发现,参与线粒体转录的所有复合物,都能被tfam–线粒体基因组通过特殊的多相相分离所招募。起初,线粒体转录聚合酶polrmt被募集在类核相分离的外层,形成壳层结构,但却不能进入tfam–线粒体基因组的核心区球体,说明这种多相相分离既可以募集转录起始复合物,也可以将转录控制在“等待”状态。继而,在转录延伸复合物的共相分离调控下,转录聚合酶polrmt打破多相相分离壁垒,进入核心区球体,组装延伸复合物,并进行转录。最后,通过另一种相分离募集转录终止复合物,终止或者抑制线粒体的转录。类似的,哺乳动物细胞的细胞核转录也是复杂复合物参与的多步骤过程。细胞核内基因组的转录依赖于rna聚合酶ii多重尾部的相分离,这一过程介导了转录因子的募集和转录机器的组装。可以推断,多相相分离可能作为一种通用机制,介导线粒体类核及细胞核的转录过程。
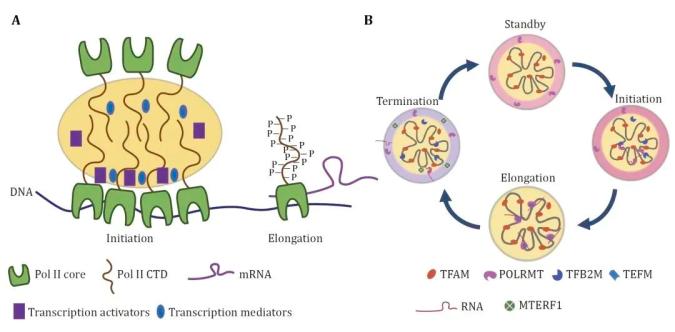
图2 相分离调控细胞核与线粒体转录
该综述全面介绍了相分离调控线粒体类核及细胞核微观结构共同机制的相关研究进展,特别论述了多相相分离对线粒体转录和细胞核转录的相似调控功能,阐释了相分离在调控细胞微观结构和功能方面的共同性,以及相分离机制在进化上的保守性。说明,相分离作为一个通用机制,可以调控线粒体类核结构的形成,以及染色质的自发组装。(来源:)
文章链接: http://www.biophysics-reports.org/en/article/doi/10.52601/bpr.2023.220018
本文转载自公众号“biophysics reports”