前沿 | 浙大医学院研究团队发现癌症诊断治疗全新靶点-pg电子官方
11月8日,浙江大学医学院吕志民、陆燕、刘鹏渊共同通讯在期刊《cell reports》上在线发表题为“pan-cancer trna-derived fragment cat1 coordinates rbpms to stabilize notch2 mrna to promote tumorigenesis”的研究论文,研究确定了cat1作为一种全癌通用表达的3'-trf,并揭示了cat1、rbpms 和 notch2 mrna 在癌细胞中协调相互作用对notch信号通路的重要调控,突显了以cat1为靶点进行非侵入性癌症诊断和治疗的巨大临床潜力。

转移rna(trna)衍生片段(trfs)是一类长度在14到50个核苷酸之间的小非编码rna(ncrna)。越来越多的证据表明内源性trfs是生物学功能分子,而不是随机的trna降解产物。trfs的生物发生似乎受到一组高度保守和精确的特异切割机制的控制。最近,trfs已被指称为参与各种分子和生理过程的参与者。trfs可以在转录水平上调控基因表达,比如在rna沉默中发挥作用。例如,来自trna-glu-ctc的5'-trf靶向apoer2基因的3' utr,降低apoer2 mrna的表达并促进呼吸道合胞病毒的复制。此外,trfs可以通过转录后调控影响基因表达。例如,leucag3'tsrna通过结合到核糖体蛋白s28(rps28)mrna的3' utr序列,促进其翻译,从而增加了用于蛋白质合成的核糖体数量。
trfs在越来越多的疾病发展中的作用已被揭示,包括神经退行性综合征、代谢紊乱、病毒感染和癌症。trfs在各种类型的癌症中经常出现异常调节,并且一些trfs的异常表达直接参与并发挥功能在癌症的进展过程中。例如,来自trnaglu、trnaasp、trnagly和trnatyr的缺氧应激诱导tirnas可以结合致癌性rna结合蛋白ybx1,导致多个致癌转录本稳定性降低,从而抑制乳腺癌的转移。此外,来自5'-trfcys的分子驱动核仁蛋白核仁蛋白寡聚化,并增强结合核仁蛋白的代谢转录本mthfd1l和pafah1b1的稳定性,从而促进肿瘤转移。然而,trfs是否通过调控关键致癌蛋白发挥肿瘤促进作用,以及它们是否可以成为液态生物标志物,目前大部分尚不清楚。
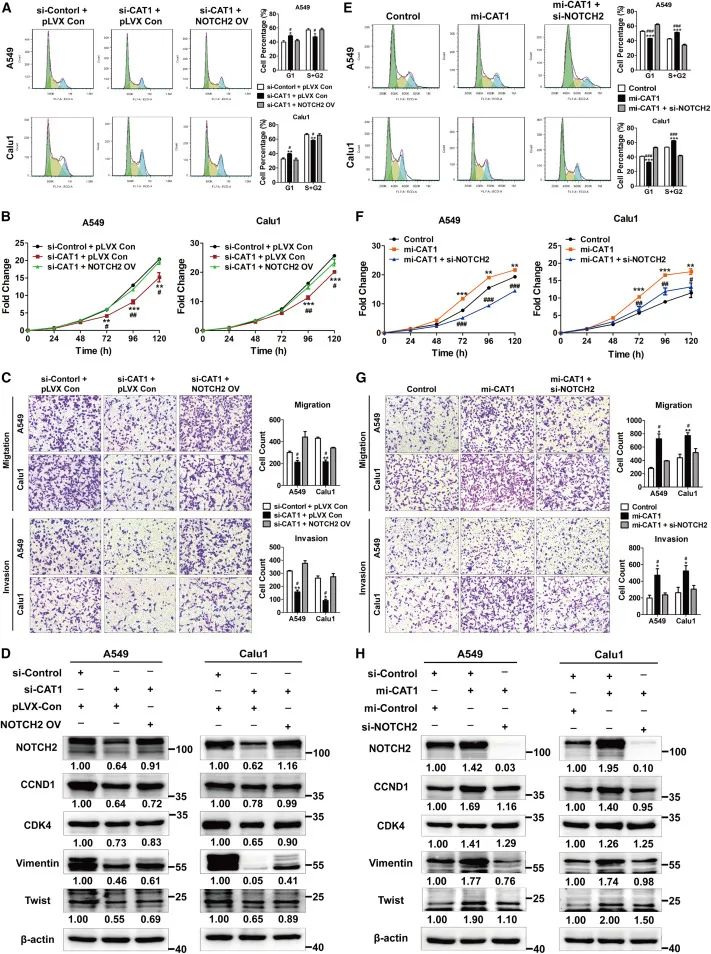
cat1通过上调notch2的表达
促进细胞周期进程和细胞增殖
研究人员检查了cat1介导以及依赖于rbpms和cnot1的notch2上调对细胞增殖和侵袭的影响。研究人员发现cat1缺失引起g1期阻滞,以及肺癌细胞增殖、迁移和侵袭的减少,可以通过notch2的过表达得到挽救。cat1敲除抑制的ccnd1、cdk4和emt标志物的表达水平也通过notch2的过表达得到了适度恢复。相反,cat1过表达促进的g1期向s期(g1/s)的转变、细胞增殖、迁移和侵袭可以通过notch2的耗竭得到废除。cat1过表达引起的ccnd1、cdk4和emt标志物的增加水平在notch2敲除后有所减少。rbpms的过表达可以抑制cat1过表达促进的notch2表达、细胞增殖和细胞周期进程。cat1敲除引起的增殖和g1期阻滞可以通过cnot1缺失得到挽救。这些数据表明,cat1通过抑制rbpms/ccr4-not介导的notch2 mrna降解来促进肺癌细胞的细胞周期进程、增殖和侵袭。
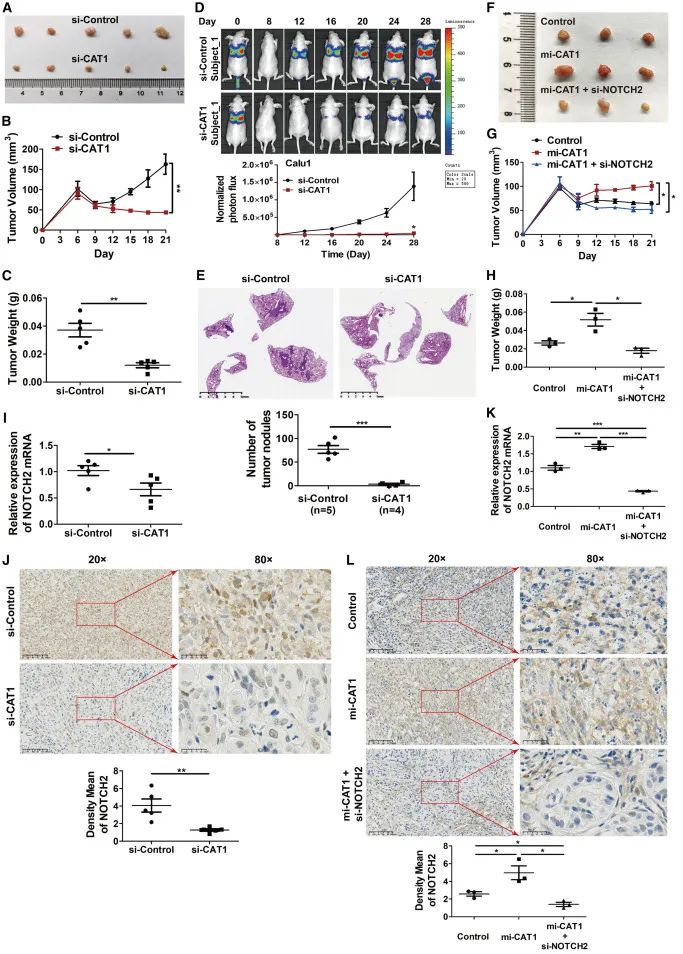
cat1通过上调notch2
促进小鼠肿瘤生长和转移
为确定cat1在肿瘤发生中的作用,分别将具有或不具有cat1耗竭的a549细胞皮下注射到裸露小鼠中。cat1的耗竭显著减少了肿瘤的大小、体积和重量,以及ki67染色。此外,具有luciferase报告基因表达的cat1耗竭的calu1细胞被尾静脉注射到裸露小鼠中。生物发光成像显示,cat1的耗竭大大减少了小鼠的转移性肺部肿瘤生长以及肺转移结节数量。相反,calu1细胞中cat1的过表达显著增加了肿瘤大小、体积、重量和ki67染色,并且这种增加可以通过notch2的耗竭来取消。实时定量pcr和肿瘤组织的免疫组化分析显示,cat1的耗竭降低了notch2 mrna的表达,并伴随着notch2蛋白水平的相应降低。相反,cat1的过表达增强了肿瘤组织中notch2 mrna的表达,并伴随着notch2蛋白水平的相应增加,而这种增加可以通过notch2的耗竭来抑制。这些数据表明,cat1通过上调notch2促进了小鼠肿瘤的生长和转移。
综上所述,研究确定了cat1作为一种全癌通用表达的3'-trf,并揭示了cat1、rbpms 和 notch2 mrna 在癌细胞中协调相互作用对notch信号通路的重要调控,突显了以cat1为靶点进行非侵入性癌症诊断和治疗的巨大临床潜力。(来源:)
参考资料:
https://www.cell.com/cell-reports/fulltext/s2211-1247(23)01420-1