前沿 | 递送新手段!利用骨骼肌融合蛋白假型病毒进行基因治疗-pg电子官方
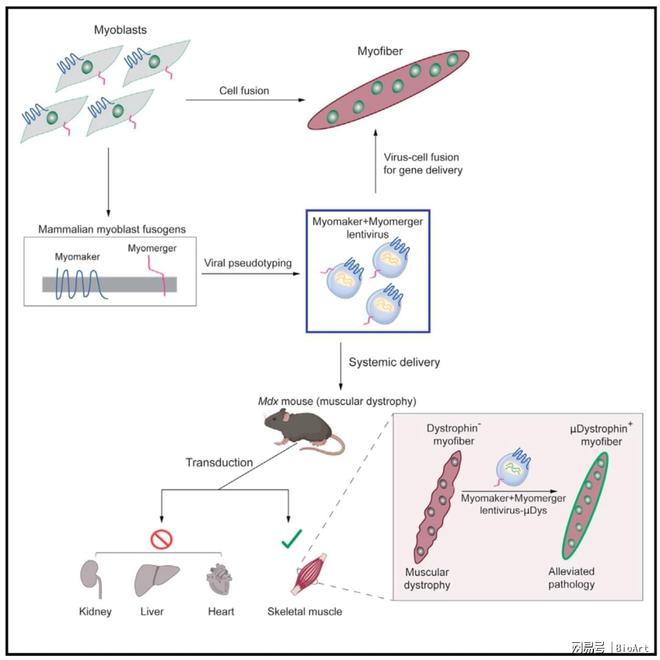
许多病毒都有病毒包膜结构,位于病毒的最外层,包膜物质通常来自于宿主细胞膜,因此携带宿主的磷脂和蛋白质,但也具有病毒的糖蛋白。病毒进入细胞是由融合蛋白介导的膜融合来实现的,骨骼肌发育过程中也需要前体细胞发生膜融合来形成多核的肌纤维,myomaker和myomerger是肌肉特异的细胞融合蛋白,它们并不类似于经典的病毒融合蛋白,这些肌肉融合蛋白是否可以功能性代替病毒融合蛋白仍不清楚。
2023年4月18日,来自美国辛辛那提儿童医院的douglas p. millay研究团队在cell上发表题为enveloped viruses pseudotyped with mammalian myogenic cell fusogens target skeletal muscle for gene delivery的文章,发现骨骼肌融合蛋白可以代替病毒融合蛋白,使病毒与细胞融合,创造了特异性靶向骨骼肌的病毒载体,可以在小鼠模型中实现对杜氏肌营养不良的靶向基因治疗。

myomaker(mymk)和myomerger(mymg)是在骨骼肌发育和再生过程中控制前体细胞形成多核肌纤维的融合蛋白,它们只在激活的成肌前体细胞中表达,对成肌细胞的融合是必需的,在成熟的肌纤维中不表达。
水疱性口炎病毒(vsv)g蛋白(vsv-g)是vsv的融合蛋白,假型包装是指用一种病毒的蛋白质包装另一种病毒基因组产生假型病毒的过程,为了研究mymk和mymg是否能促进病毒膜的融合,研究人员首先利用一种vsv突变体,即用gfp代替了vsv-g(vsvg),然后将细胞系转染mymk和mymg,用病毒转导细胞,发现可以转导表达mymk和mymg的细胞,而不能转导未表达mymk和mymg的对照细胞。
接下来他们想要利用这一平台来实现安全有效的肌肉靶向治疗载体,由于vsv在临床上有很多局限性,他们利用可以整合到基因组的慢病毒,构建了诱导性表达mymk和mymg的产生病毒的细胞系,得到mymk mymg的假型慢病毒,然后转导目的细胞,发现可以特异性转导表达mymk和mymg的细胞系,并且可以转导80%的肌管,而转导成肌细胞的效率很低,不能转导成纤维细胞。
然后他们检测了这种假型慢病毒是否可以在体内转导肌肉细胞,用心脏毒素损伤前胫骨肌,4天后注射病毒,发现mymk mymg的假型慢病毒可以转导正在经历融合的骨骼肌,并且对杜氏肌营养不良模式小鼠注射mymk mymg的假型慢病毒,发现也可以转导肌纤维。进一步他们发现mymk mymg的假型慢病毒靶向的是成肌前体细胞,并且在系统性递送之后,mymk mymg的假型慢病毒可以特异性转导骨骼肌。
最后他们利用mymk mymg的假型慢病毒来递送治疗性的遗传物质,即迷你型dystrophin(dys5),到营养不良的肌肉,可以缓解病理症状。
利用骨骼肌融合蛋白假型病毒进行基因治疗
总的来说,这项研究揭示了骨骼肌融合蛋白可以替代病毒融合蛋白,实现病毒对骨骼肌的特异性转导,从而可以创造出特异性靶向骨骼肌的病毒载体,在小鼠上可以用于治疗杜氏肌营养不良,未来利用这种特异性靶向骨骼肌的病毒载体进行相应肌肉疾病的基因治疗可能是一个有潜力的应用方向。(来源:bioart )